|
Авторы Антрапцева Н.М., Пономарева И.Г., Ткачева Н.В., Бондарь Л.А., Национальный аграрный университет, Киев, Украина С истема мероприятий по охране окружающей среды от загрязняющих веществ включает борьбу с коррозией металлов в различных областях хозяйственной деятельности человека. Особенно остро данная проблема стоит при использовании замкнутых систем водоснабжения, в которых ситуация осложняется повышенной температурой воды.Поэтому поиск новых экологически безопасных ингибиторов коррозии для таких систем является особенно актуальным. Одним из способов защиты металлов от коррозии является использование различных металлических и неметаллических покрытий. Основным недостатком такого предотвращения процессов разрушения металлов и металлических конструкций является их возможное отслоение от поверхности основного металла, вызванное распространением ржавчины под слоем защитного покрытия [6].
Этого недостатка в значительной мере лишены фосфатные покрытия [3,5]. Эффективными для защиты металлов и техники от коррозии оказались, по мнению [3,5], не только покрытия, а и ингибиторы коррозии на основе моно- и полифосфатов.Так, среди монофосфатов в качестве ингибиторов коррозии известны фосфаты аммония, натрия, меди [1], полифосфаты натрия. Они проявляют ингибирующее действие на коррозию, которая сопровождается кислородной деполяризацией [6]. Авторы [6] отмечают, что полифосфаты кальция,железа и цинка проявляют еще больший ингибирующий эффект, чем полифосфаты натрия. Однако механизм их защитного действия остается мало изученным. Эффективное использование полифосфатов в разных условиях требует систематических экспериментальных исследований. Данные об ингибирующем действии дифосфатов марганца (ІІ) и цинка в литературе практически отсутствуют. Цель данной работы — исследовать торможение коррозийных процессов под влиянием дифосфатов марганца (ІІ) и цинка. Методика исследований В качестве основных объектов исследования использовали дифосфаты марганца (II) и цинка состава Mn 2 P 2 O 7 . 5Н 2 О, Zn 2 P 2 O 7 . 5Н 2 О. Получали их осаждением катионов Mn 2+ и Zn 2+ дифосфат-ионом P 2 O 7 4- при взаимодействии стехиометрических количеств водных растворов сульфата двухвалентного металла и дифосфата калия [2]. Коррозионные исследования на образцах стали марки 08 кп (прямоугольные пластинки с рабочей поверхностью 8 см 2 ) проводили гравиметрическим методом. В качестве модельной коррозийной среды использовали 5 . 10 -3 моль/л раствор H 2 SO 4 (фон). Ингибирующими добавками служили гидратированные дифосфаты марганца (ІІ) и цинка, концентрация которых в растворе составляла 5 . 10 -3 моль/л. Рабочую концентрацию дифосфатов устанавливали в отдельной серии опытов, варьируя их концентрации от 2,5 . 10 -3 до 6,5 . 10 -3 моль/л. Максималь ный ингибирующий эффект наблюдался при концентрации 5 . 10 -3 моль/л. Предварительная обработка образцов стали включала зачистку и полировку их поверхности шлифовальной бумагой с последующим химическим обезжириванием в щелочном растворе состава (г/л): Na 3 PO 4 . 12 H 2 O — 50, Na 2 CO 3 — 23, Na 2 S іО 3 — 7. Процесс обезжиривания проводили в течении 25 мин. при температуре раствора 80-90 °С. После чего образцы промывали дистиллированной водой, сушили и взвешивали. Непосредственно перед испытаниями образцы стали активировали в 3 моль/л растворе H 2 SO 4 на протяжении 30 с. Подготовленные образцы стали погружали в растворы дифосфатов и выдерживали при комнатной температуре на протяжении 168 часов. По окончании опыта с поверхности образцов стали удаляли продукты коррозии, высушивали их и взвешивали. Результаты взвешиваний использовали для дальнейших расчетов. Скорость коррозийного разрушения стали оценивали по величине массового показателя скорости коррозии, которую рассчитывали по формуле [1]: 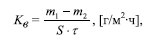
где m 1 , m 2 — масса образца стали до и после испытаний, соответственно, г; S — площадь поверхности образца, м 2 ; ô — продолжительность опыта, ч. Для количественной оценки защиты стали рассчитывали коэффициент торможения скорости коррозии ã и степень защиты металла Z . Расчеты про водили по формулам: 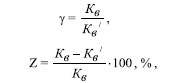
где Кв , Кв / — скорость коррозии до и после защиты, соответственно. Результаты и их обсуждение Результаты визуальных наблюдений показали, что при отсутствии добавок дифосфатов сталь в растворе кислоты корродирует локально. Уже через 10-12 часов после погружения образцов в раствор на их поверхности появлялись отдельные очаги коррозии в виде пятен. За время опыта они увеличивались и покрывались «шапкой» продуктов коррозии. В присутствии добавок гидратированных дифосфатов на поверхности образцов стали отмечалось образование плотных пленок светло-серого цвета. Гравиметрические коррозийные исследования показали ( табл. ), что в стационарных условиях (при бестоковом коррозионном потенциале) добавление до 5 . 10 -3 моль/л раствора H 2 SO 4 дифосфата марганца (ІІ) приводит к снижению скорости коррозии стали по сравнению с фоном в 3 раза ( ã = 3,09), что соответствует степени защиты 67,7%. 
При добавлении в раствор кислоты дифосфата цинка скорость коррозии стали уменьшается в 2 разa ( ã = 2,16), степень защиты стали — 53,8% ( табл. ). Анодные и катодные поляризационные зависимости, снятые с помощью потенциостата П5827М в фоновом растворе без добавок и с добавками дифосфатов марганца и цинка представлены на рис . 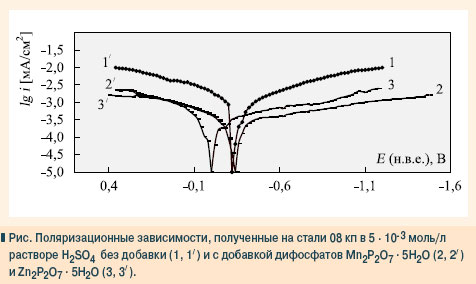
Как свидетельствуют данные рис. , присутствие дифосфатов в растворе кислоты существенно изменяет ход поляризационных зависимостей ( рис ., кривые 2, 2 / , 3, 3 / ) по сравнению с фоном ( рис ., кривые 1, 1 / ).Плотность тока ( lg i ) анодной поляризационной зависимости в присутствия Mn 2 P 2 O 7 . 5Н 2 О (кривая 2 / ) уменьшается по сравнению с фоном практически на порядок во всей области исследованных потенциалов.Дифосфат цинка больше влияет на скорость анодного процесса в области небольших анодных поляризаций (-0,18 . 0 В), где плотность анодного тока уменьшается более чем на порядок (кривая 3 / ). Так, при потенциале - 0,18 В плотность тока в фоновом растворе составляет -2,64 и понижается в присутствии дифосфата цинка до -4,11, а дифосфата марганца — -3,32 мА/см 2 . При катодной поляризации (кривые 1, 2, 3) добавление к раствору H 2 SO 4 дифосфата марганца (ІІ) уменьшает плотность тока ( lg і ) в большей степени, чем Zn 2 P 2 O 7 . 5Н 2 О. При потенциале -1,0 В, например, в фоновом растворе плотность катодного тока составляет -2,15 мА/см 2 , в присутствии дифосфатов цинка и марганца (ІІ) она уменьшается до -2,81 и -3,09 мА/см 2 , соответственно. Величина потенциала коррозии постоянные ( Е ) относительно нормального водородного электрода в фоновом растворе составляет -0,32 В ( рис. ). При добавлении к нему дифосфата цинка значение потенциала коррозии увеличивается до -0,20 В, наблюдается смещение поляризационных кривых на 150 мВ в сторону более положительных значений, характеризуя преимущественно торможение скорости анодной реакции (кривые 3, 3 / ). Такой эффект можно объяснить образованием на стали тонкой защитной пленки фосфатов цинка, которые блокируют поверхность стали и тормозят скорость коррозийного разрушения. Потенциал коррозии стали в случае присутствия в растворе H 2 SO 4 дифосфата марганца (ІІ) смещается в сторону более отрицательных значений (на 20 мВ), что свидетельствует о преобладающем торможении катодной реакции. Учитывая, что катодный процесс восстановления водорода в кислых средах является достаточно сложным и многостадийным, антикоррозийное влияние дифосфата марганца, скорее всего, обусловлено повышением перенапряжения выделения водорода и снижениям активности центров, на которых происходит восстановление ионов Н + . Таким образом, как показали результаты исследования влияния дифосфатов марганца и цинка на коррозийные процессы на стали в кислой среде, добавление их к раствору тормозит обе электродные реакции — анодную реакцию растворения стали и катодную реакцию восстановление деполяризатора. Выводы 1. Добавление дифосфатов марганца и цинка к кислым растворам повышает коррозийную стойкость стали за счет образования на ее поверхности плотных защитных пленок. 2. Механизм действия дифосфатов цинка и марганца (ІІ) несколько отличается: дифосфат марганца в большей степени тормозит скоростькатодного процесса на стали, дифосфат цинка — анодного. 3. Исследованные дифосфаты можно применять в качестве ингибиторов коррозии стали в замкнутых системах водоснабжения, а также как составляющие растворов для получения фосфатных конверсионных покрытий. ■ Литература 1. Алцыбеева А.И., Левин С.З. Ингибиторы коррозии металлов. Справочник. — Л.: Химия, 1968.— С. 264. 2. Антрапцева Н.М., Клюгвант А.А. Визначення оптимальних умов одержання дифосфату цинку пентагідрату // Вопросы химии и химической технологии. — 2003. — № 4. — 17-19 c. 3. Кузнецов Ю.И. Ингибиторы коррозии в конверсионных покрытиях // Защита металлов.— 2001. — Т. 37. — № 2. — 119-125 c. 4. Новицкий В.С., Писчик Л.М. Коррозионный контроль технологического оборудования. — К. :Наукова думка, 2001. — C. 171. 5. Сциборовская Н.Б. Оксидные и цинко-фосфатные покрытия металлов.— М.: Оборонгиз, 1961. — C. 170. 6. Улиг Г.Г., Реви Р.У. Коррозия и борьба с ней. Введение в коррозионную науку и технику. — Л.: Химия, 1989. — C. 456. |









